恶性肿瘤是严重威胁人类健康的重大疾病,除传统手术、疗、放疗等治疗手段外,核素内照射治疗作为肿瘤治疗 新策略日益受到临床关注。用于核素内照射治疗的有α核素、β核素和俄歇电子等;每种核素都有其自身的衰变特性、传能线密度(linear energy transfer, LET)、辐射范围和化学特性等。尽管β核素在靶向肿瘤治疗中的有效性已被证明, 但在微小肿瘤及弥漫性微转移肿瘤的治疗中受到很大的限制;而α核素靶向治疗(targeted a-therapy, TAT)有望成为这类肿瘤的治疗方法。
一、靶向治疗相关的α核素
α核素本质为氮原子核,释放射线的LET值为50- 230 keV/µm,其相对生物学效应是β核素的3~7倍,表现为 DNA双链在有丝分裂或重排期发生不可修复性断裂。一般辐射范围在28-100相当于6~8个真核细胞的直径 (10-50µm),可明显提高单位吸收剂量的细胞死亡率,降低骨髓毒性,并限制射线的过度暴露。α核素不仅能特异性杀伤靶向的肿瘤细胞,还可以通过交叉火力效应(cross-fire effect)、辐射诱导旁观者效应(radiation induced bystander effect, RIBE)及远隔效应(abscopal effect)等诱导非靶向细胞的直接或间接死亡。而且乏氧细胞对α射线的灵敏度与常氧细胞相似,避免了肿瘤异质性对放疗的耐受,克服了传统放化疗的不足。
α核素虽可达数百种,但能应用到靶向治疗药物的并不多,包括223Ra,2llAt,225Ac,2l3Bi,227Th等,每种核素都具有各自的物理特性(表1)。
1. 223Ra。 2013年美国食品与药品监督管理局批准了223RaCl2 (Xofigo)用于治疗伴有骨转移但无脏器转移的去势抵抗性前 列腺癌(castration resistant prostate cancer, CRPC),这是第一个被批准应用于临床的α核素药物。223 Ra虽然缺乏与之匹配的螯合剂,但可模拟钙离子,通过与骨骼中的羟基磷灰石形成复合物,选择性地靶向骨骼(尤其是骨转换活跃的部位)。临床Ⅲ期研究表明,CRPC患者接受完整6个周期的223Ra治疗后可提高总生存期及减少骨痛;223 Ra在治疗高风险骨肉瘤中也安全有效,其不良反应为轻度骨髓抑制,但对于伴有淋巴结和骨髓转移患者的治疗无效。
2、211At。 At属于卤族元素,性质与碘相似,具有某些金属特性。生产211At最常见的模式是a射线对209 Bi靶的辐照。发生核反应209 Bi(a,2n)2llAt的a射线最佳能量为29.17 MeV,可减少副反应产物210At的生成,避免其衰变后子核素210Po沉积造成肝、肾毒性及骨髓抑制效应。211At可通过2条途径衰变成稳定性核素207Pb(图1)。其中,经电子俘获衰变成211 Po的过程中发射77-92 keV的X射线,使得体内成像及量化211At的放射性分布成为可能。
表1几种α核素的物理特性

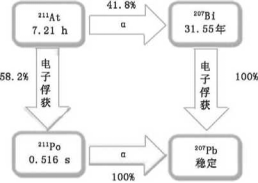
图1 211At衰变纲图
At的化学性质多样,合成211At标记化合物大多利用其卤素特性。通过与螯合剂如各种金属有机衍生物(特别是Sn)或碳硼烷前体等形成相应化学键,可以结合靶向恶性肿 瘤细胞群的分子载体,制备TAT药物。迄为止,已经研究了211At与抗体、胸腺唾嚏类似物、生物素类似物、胶体、黑色素前体及双麟酸盐等载体的结合,对于实体肿瘤(需要较长的放射性药物穿透时间)或不易穿透的部位(靶向剂被缓慢吸收),具有较长半衰期的211At是分子靶向治疗的良好α核素之一。
3. 225Ac。225Ac是衰变级联中的母体α核素,其产生3种净α子核素:221Fr(半衰期4.8 min)严At(半衰期32.3 ms) 和2'3Bi(半衰期45.6 min),最后达到稳定的209Bi。使用纳米微粒对225Ac进行包封,可防止衰变后的高反冲能量导致子核素从螯合剂中释放,减少其对正常组织产生不良反应(如213Bi沉积在肾脏中)。该放射性核素发生器系统对肿瘤的辐射剂量比仅发射单一α射线的放射性核素更高。鉴于225Ac的长半衰期、高α粒子发射能量和稳定押Bi衰变链,其被认为是用于肿瘤治疗的有效手段。
4. 其他α治疗核素。2l3Bi由于其较短的半衰期,可将225Ac/ 2l3Bi发生器作为体内放射性核素发生器使用。已有研究将2l3Bi应用于急性髓系白血病及胶质母细胞瘤等患者的治疗,展现出作为TAT的优势。此外,227Th也可作为衰变级联中的母体核素,衰变链产生5个α粒子和2个β粒子,最后达到稳定性核素207Pb。
二、靶向治疗的载体
放射性核素和靶向载体应在给药途径、可靶向性和作用部位等方面相互匹配,因此,选择最佳的肿瘤相关抗原和靶向分子载体是核素靶向治疗的关键。理想的抗原应该在肿瘤细胞呈高表达,而在正常细胞呈低表达。这些靶向分子如单克隆抗体(monoclonal antibodies, mAbs)、多肽、小分子化合物和纳米颗粒等,能够特异性地将α核素运送至靶点,精准杀伤肿瘤细胞。近年来TAT药物的应用研究进展见表2。
1. mAbs。目前,TAT使用的载体多为mAbs,这是由成熟B细胞克隆产生的高度均一、仅针对某一特定抗原表位(如肿瘤相关生物标志物等)的抗体。当放射性药物中的mAbs靶向肿瘤细胞时,形成的免疫复合物迅速内化,将携带的α核素在细胞内释放,同时其衰变产生的子核素也被隔离在细胞内。这保证TAT药物的作用过程在肿瘤细胞内进行,减少对细胞外基质及正常组织的损伤關。但由于其相对分子质量较大,以mAbs为载体的TAT药物的药代动力学效果不理想。
2. 小分子化合物或肽类。小分子化合物或肽类也可用作TAT的特异性探针及载体,如抗前列腺特异膜抗原(prostate specific membrane antigen, PSMA)小分子抗体、P物质、间成苯脈(meta-astatobenzylguanidine, MABG)等。因其在体内循环较快,可减轻骨髓毒性,且更易进入肿瘤或正常组织中mAbs扩散受限的区域。然而,由于其在肿瘤组织中滞留时间短,因此会影响TAT的作用效果。
3. 纳米颗粒。纳米颗粒具有许多特性:(1)高稳定性;(2)对同源抗原具有高亲和力和特异性;(3)相对分子质量小,易于通过血-脑屏障;(4)低免疫原性,可快速清除,与其他组织的非特异性结合少。利用纳米载体特异性地传递α核素的方法已经被用于肿瘤、炎性反应和心血管疾病等的显像及治疗,如用于靶向血管内皮(碳纳米管和脂质体)、早 期微转移癌(脂质体)和实体肿瘤(碳纳米管、脂质体和纳米 沸石)等。纳米抗体具有高肿瘤亲和性、低背景信号和快速肾排泄的特点,可能是TAT的理想载体。在临床应用中,仍需对结合的各种放射性核素及螯合剂类型进行评估,还需评估其剂量学和治疗效果等,以确定最佳的药物结构。
表2不同α核素靶向治疗药物的应用




